不同霉菌毒素对猪和鼠卵子毒性作用的比较研究
陆玉洁1,张悦1,刘佳倩1,邹鹏1,贾璐1,苏永腾2,孙育荣2,孙少琛1
1. 南京农业大学动物科技学院,南京 2. 江苏奥迈生物科技有限公司,南京
摘要
研究背景:黄曲霉毒素B1(AFB1)、脱氧雪腐镰刀菌烯醇(DON)、HT-2毒素、赭曲霉毒素A(OTA)、玉米赤霉烯酮(ZEA),这些毒素是玉米饲料中最常见的霉菌毒素,并且对动物和人类有多重毒性作用。以前的研究中可知霉菌毒素会损伤哺乳动物卵母细胞的质量,而且这些毒素对动物卵母细胞的有效浓度是不同的。
试验方法:本研究旨在比较小鼠和猪卵母细胞对AFB 1、DON、HT-2、OTA和ZEA的敏感性。我们以小鼠和猪卵母细胞的极体排出率为标准,研究霉菌毒素对卵母细胞成熟的影响。
实验结果与讨论:结果表明,10μM AFB1和1μMDON对猪卵母细胞成熟的影响显著高于50μMAFB1和2μMDON对小鼠卵母细胞的影响。然而,与50nMHT-2对猪卵母细胞的影响相比,10nMHT-2对小鼠卵母细胞成熟的影响更加显著。另外,5μMOTA和10μMZEA对猪卵母细胞的成熟有显著影响,而对小鼠卵母细胞成熟的影响浓度分别为300μM和50μM。我们的结果表明,除了HT-2毒素之外,猪卵母细胞对AFB1、DON、OTA和ZEA的敏感性高于小鼠卵母细胞。
关键词:卵母细胞、减数分裂、霉菌毒素、猪、小鼠
一 引言
霉菌毒素是真菌或霉菌代谢产生的次生代谢产物,黄曲霉毒素(AF)、脱氧雪腐镰刀菌烯醇(DON)、T-2、赭曲霉毒素A(OTA)、玉米赤霉烯酮(ZEA)是目前已知的最常见的霉菌毒素。这些霉菌毒素会以非常小的剂量对人体和动物的健康产生毒性作用,现已经引起了全世界的关注。
黄曲霉毒素是玉米饲料中广泛存在的霉菌毒素。黄曲霉毒素B1(AFB1)的毒性和致癌作用使它成为最重要的黄曲霉毒素,它可引起DNA损伤,氧化应激,凋亡等多种影响,而在猪卵母细胞中,AFB1可影响细胞周期并引起氧化应激。
脱氧雪腐镰刀菌烯醇主要由真菌产生,是玉米、小麦和大麦等谷物中最常见的污染物。用被DON污染的饲料饲喂家畜家禽之后,它会存在于在鸡蛋,牛奶,肉里面。在动物体内,它会引起器官损伤和肝脏脂质积聚,呕吐、厌食、生长迟缓、免疫毒性以及生殖和发育能力受损。在细胞和分子水平上,DON可以诱导细胞凋亡,氧化应激与遗传毒性,另外,以往的研究表明DON对猪卵母细胞的纺锤体形态有影响。
HT-2是T-2的主要代谢产物,它们属于A类单端孢霉烯族毒素。HT-2会引起多种影响,包括抑制蛋白质、DNA和RNA的合成,以及氧化应激;降低生殖能力。
OTA可以由赭曲霉,炭疽菌A.,黑曲霉,疣青霉等真菌产生。OTA对家畜有毒性,其主要靶器官是肾脏。OTA可以引起免疫毒性、肝中毒、凋亡、细胞活力下降,还可以影响小鼠卵母细胞成熟与胚胎发育。
ZEA是由镰孢霉菌产生的一种霉菌毒素,在结构上类似于雌二醇,它和雌二醇竞争与雌激素的受体结合,从而导致生殖障碍。ZEA的遗传毒性也已经被证实,它会导致DNA断裂、凋亡和细胞周期的中断。几项研究表明,ZEA降低了猪卵母细胞的发育能力。
在以前的研究报告中提到,霉菌毒素的几个组成部分损害哺乳动物卵母细胞的质量,但是在不同动物模型的卵母细胞中,有不同的有效浓度。虽然AFB1、DON、HT-2、OTA和ZEA均有体内代谢产物,但这些霉菌毒素均在卵巢中检测到,说明除其代谢产物外,AFB1、DON、HT-2、OTA和ZEA还可直接影响卵巢功能。本研究旨在比较小鼠和猪的卵母细胞对AFB1、DON、HT-2、OTA和ZEA的敏感性,为今后霉菌毒素的研究提供基础数据。我们采用小鼠和猪卵母细胞的极体排出率作为霉菌毒素对卵母细胞成熟的毒性效应的标准,结果表明除HT-2外,猪卵母细胞对AFB1、DON、OTA和ZEA的敏感性高于小鼠卵母细胞。
二 实验材料和方法
1.试剂
AFB1,DON,HT-2,OTA,和ZEA来自J&K化学试剂公司(中国上海)。TCM-199来自GIBCO(Life Technologies,美国)。TCM-199其中含有75μg/ml青霉素,50μg/ml链霉素,0.5μg/ml促卵泡素,0.5μg/ml促黄体素,10ng/ml表皮生长因子,用于卵母细胞成熟。M2和M16培养液购自Sigma(Merck; St. 美国).
2.卵母细胞采集和培养
我们遵循南京农业大学动物研究所委员会的指导方针(SYXK-Su-20170007),取3-5周龄ICR小鼠的生发泡-完整卵母细胞在M2培养基中,M16培养液覆盖石蜡进行培养,将小鼠卵母细胞置于37℃,5%CO2溶液中12h,观察极体排出情况。
杜洛克猪的卵巢是在当地丰永食品业的屠宰场购买的。屠宰后,将卵巢放在装有0.9%生理盐水的保温瓶中,然后在2小时内送到实验室。保温瓶的温度接近38℃。取10ml一次性注射器抽取卵丘卵母细胞复合体(COCs),然后将卵母细胞置于38.5℃,5%CO2培养44h,观察卵母细胞极体排出情况。
3.毒素处理
将AFB1,DON,HT-2,OTA和ZEA溶于DMSO中,浓储配制成50mM,然后用TCM199或M16成熟培养液稀释成不同浓度。将GV期的卵母细胞与这些霉菌毒素共同培养,对照组加入等量的DMSO,用极体排出率分析卵母细胞的成熟率。
4. 数据分析
数据以平均数表示(n=3),浓度曲线图是由GraphPad Prism 5制作。每次分析至少使用三次重复实验的数据,每次重复是在不同的时间通过一个独立的实验完成的。结果为平均值±SEM,两组数据进行T检验,p值<0.05为显著。
三 结果
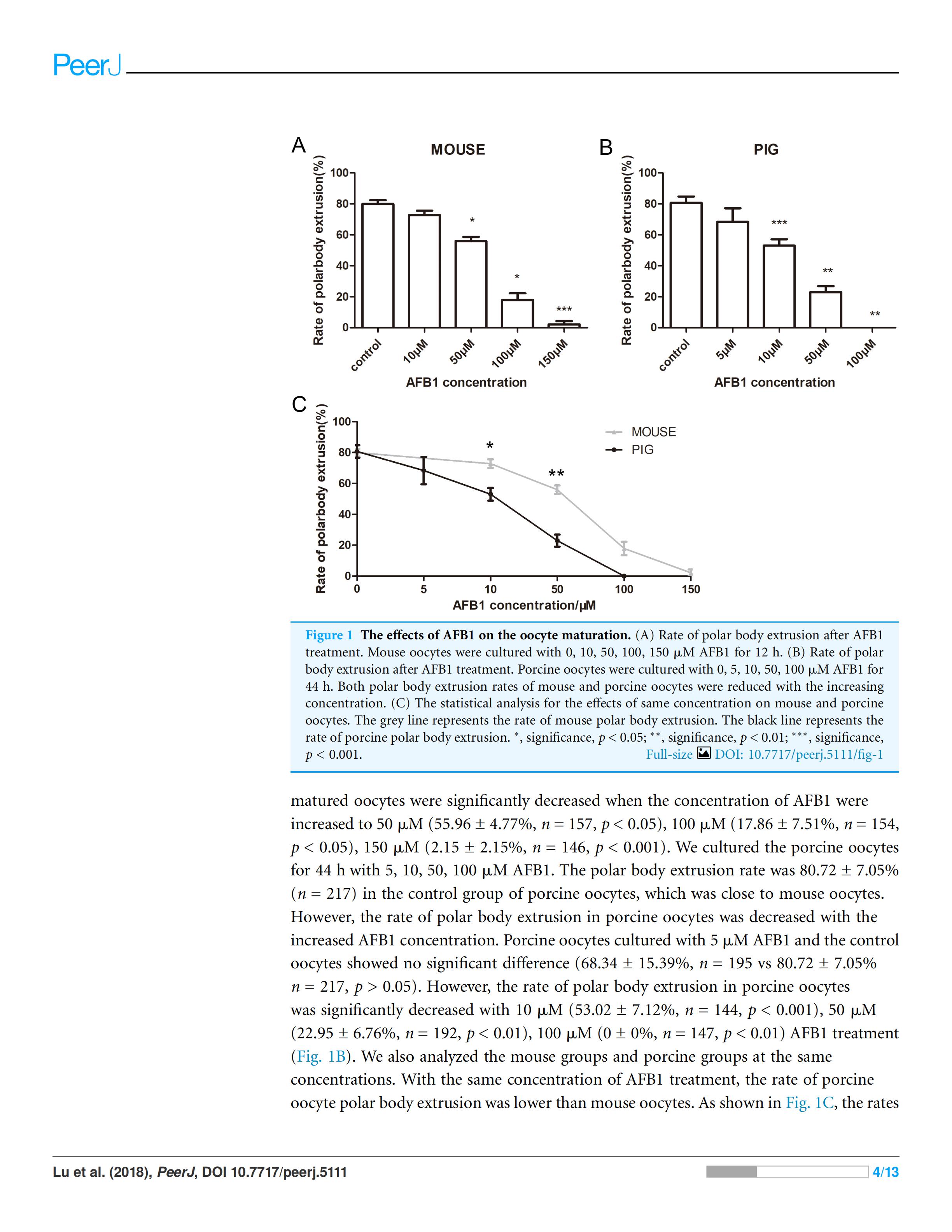
1. AFB1对小鼠和猪卵母细胞成熟的影响
我们首先观察了AFB1对小鼠和猪卵母细胞的影响,用10、50、100和150μM的AFB1培养小鼠卵母细胞12h,对照组的平均极体排出率为79.94±4.3%(n=142)(Fig. 1A)。与对照组相比,10μMAFB1培养的卵母细胞极体排出率无显著性差异(72.82±4.83%,n=110,p>0.05)。当AFB1浓度增加到50μM(55.96±4.77%,n=157,p<0.001),100μM(17.86±7.51%,n=154,p<0.05),150μM(2.15±2.15%,n=146,p<0.001)时,卵母细胞排极体率明显减少。
猪卵母细胞在浓度为5、10、50、100μM的AFB1培养基中培养44h。对照组极体排出率为80.72±7.05%(n=217),接近小鼠对照组卵母细胞的成熟率,但随着AFB1浓度的增加,猪卵母细胞极体排出率降低。猪卵母细胞经5μMAFB1培养后与对照组卵母细胞比较,无显著差异(68.34±15.39%,n=195,80.72±7.05%,n=217,p>0.05),而10μM(53.02±7.12%,n=144,p<0.001)50μM(22.95±6.76%,n=192,p<0.01),100μM(0±0%, n=147, p<0.01)的AFB1处理组,卵母细胞成熟率则显著降低(Fig. 1B)。
我们还分析了在相同浓度的AFB1处理下小鼠组和猪组,猪卵母细胞极体排出率低于小鼠卵母细胞。如图Fig.1C所示,小鼠和猪卵母细胞的对照组之间无显著差异(p>0.05),而在10μM(p<0.05)和50μM(p<0.01)的浓度下,猪卵母细胞的排极体率显著低于小鼠卵母细胞(p<0.01),表明猪卵母细胞对AFB1的敏感性高于小鼠卵母细胞。
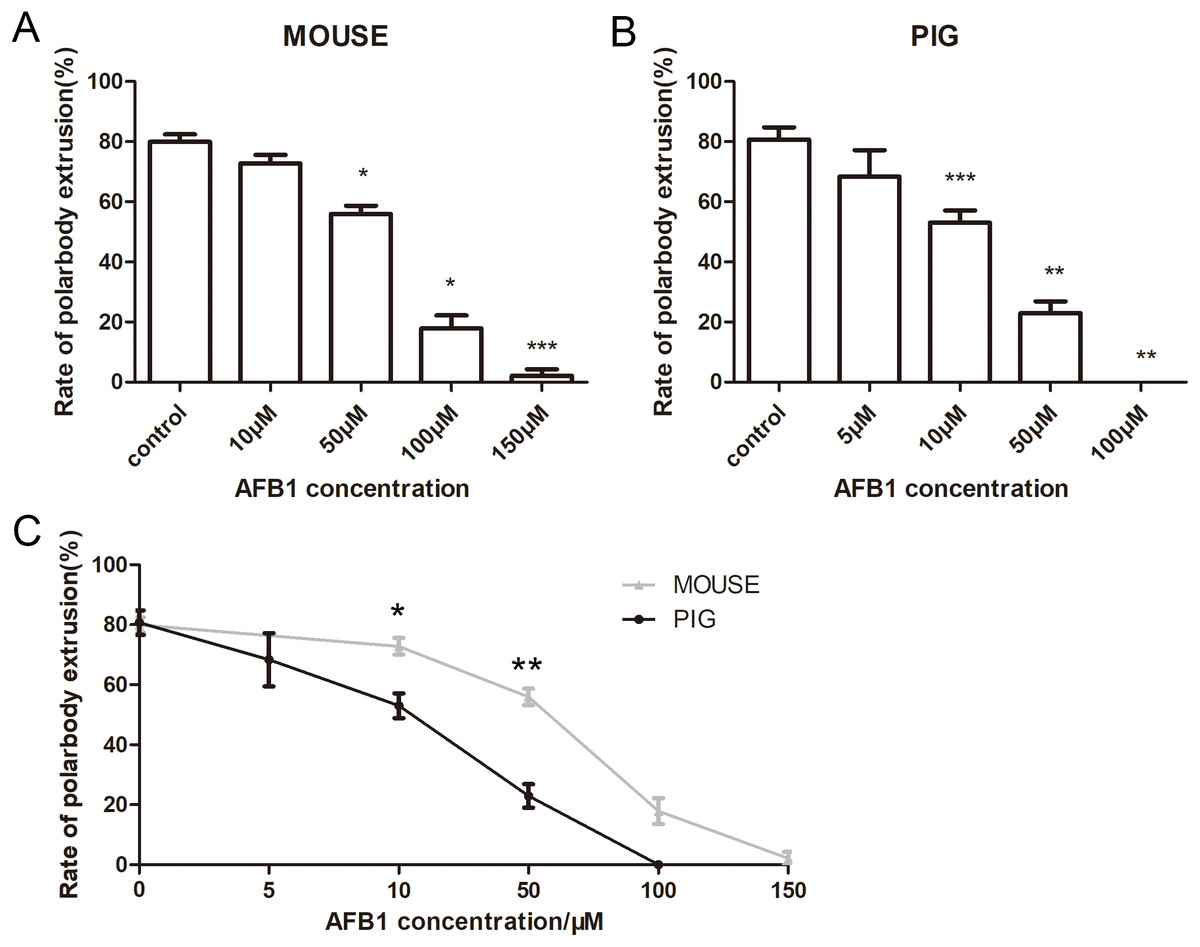
Figure 1 AFB1对卵母细胞成熟的影响(A)小鼠卵母细胞经AFB1处理后极体排出率。用浓度为0, 10, 50、100, 150μM的AFB1培养小鼠卵母细胞12 h。(B)用浓度为0、5、10、50、100μM的AFB1培养44h的猪卵母细胞极体排出情况。随着浓度的增加,小鼠和的猪卵母细胞的极体排出率均降低。(C)在相同浓度的AFB1下对小鼠和猪卵母细胞影响的统计分析。灰色线代表鼠卵母细胞极体排出率,黑线代表猪卵母细胞极体排出率。*,显著,P<0.05;**,显著,P<0.01;***,显著,P<0.001。
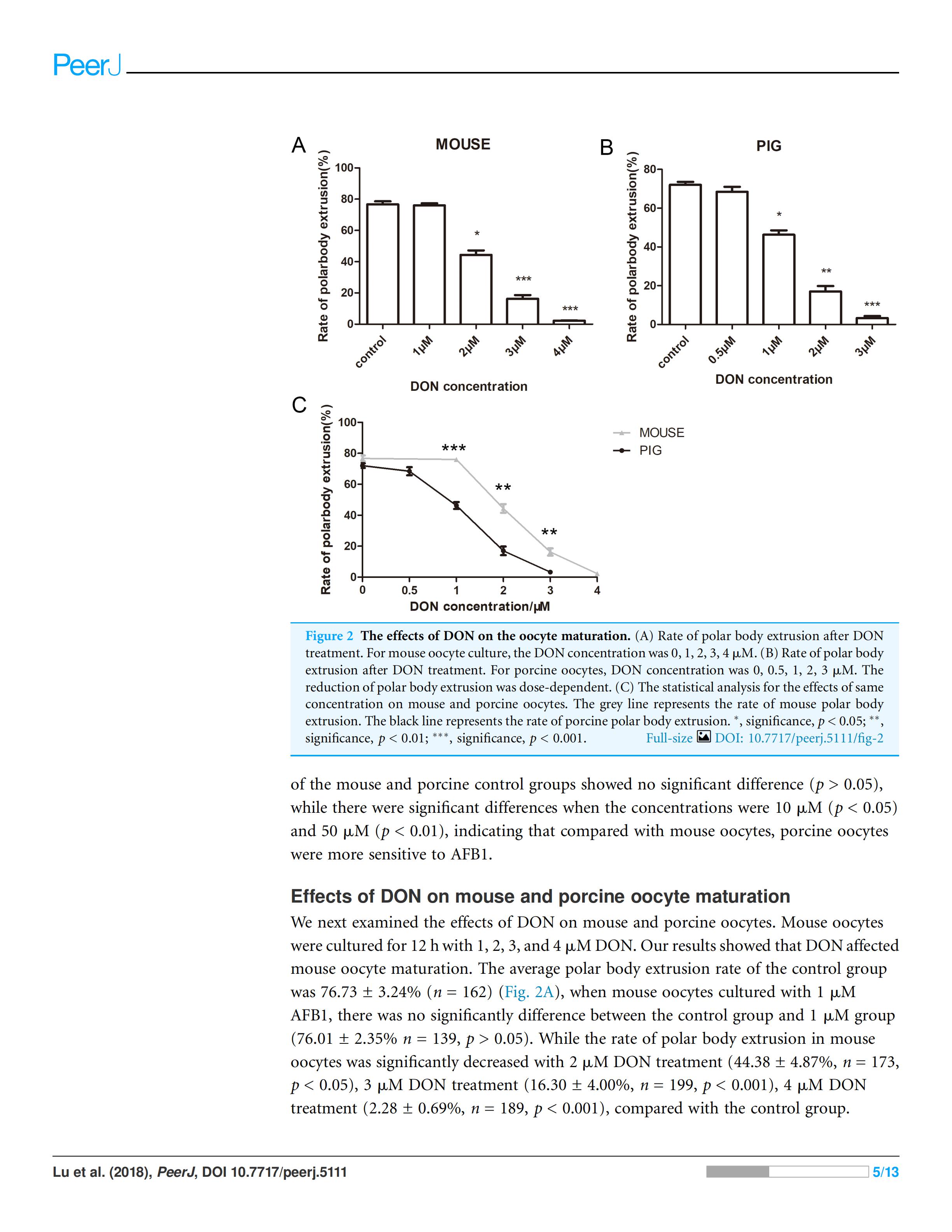
2. DON对小鼠和猪卵母细胞成熟的影响
我们接着观察了DON对小鼠和猪的卵母细胞的影响,用1、2、3和4μM浓度的DON分别培养小鼠卵母细胞12h,结果表明DON影响小鼠卵母细胞成熟。小鼠对照组的平均极体排出率为76.73±3.24%(n=162)(Fig. 2A),1μMAFB1培养的小鼠卵母细胞与对照组比较无显著性差异(76.01±2.35%n=139,p>0.05)。2μMDON处理(44.38±4.87%,n=173,p<0.001),3μMDON处理(16.30±4.00%,n=199,p<0.001),4μMDON处理(2.28±0.69%,n=189,p<0.001)的小鼠卵母细胞与对照组相比极体排出率显著降低。
猪卵母细胞在0.5、1、2、3μM浓度的DON中培养44h,其对照组极体排出率为72.05±2.6%(n=195),与小鼠卵母细胞对照组极体排出率相近,0.5μM的DON(68.42±4.55%,n=159,p>0.05)处理组与对照组相比,无显著性差异(P>0.05)。1μMDON处理(46.29±3.89%,n=176,p<0.001),2μMDON处理(17.02±4.87%,n=145,p<0.01),3μMDON处理(3.29±1.81%,n=132,p<0.001)与对照组相比,猪卵母细胞极体排出率明显降低(Fig. 2B)。
为了比较小鼠和猪卵母细胞对DON的敏感性,我们还分析了在1μM(p<0.001)、2μM(p<0.01)、3μM(p<0.01)DON的相同浓度下小鼠组和猪组的极体排出情况,小鼠卵母细胞和猪卵母细胞的极体排出率有显著性差异(P<0.01)(Fig. 2C)。表明与小鼠卵母细胞相比,猪卵母细胞对DON更敏感。
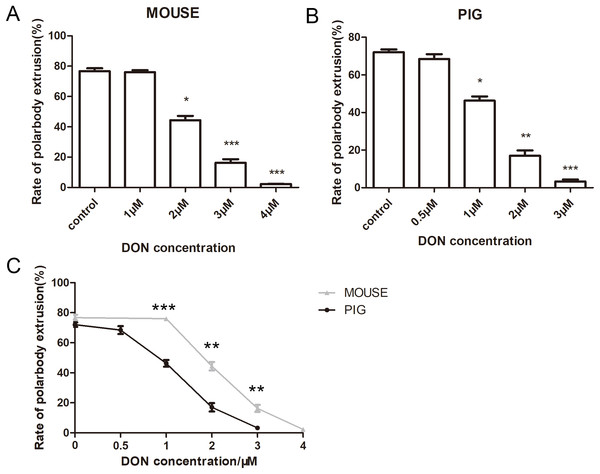
Figure 2 DON对卵母细胞成熟的影响(A)DON处理后小鼠卵母细胞的排极体率,DON浓度为0,1,2,3,4μM,卵母细胞排极体率随着浓度的增减呈递减趋势(B)用浓度为0,0.5,1,2,3μM的DON处理猪卵母细胞,卵母细胞排极体率随着浓度的增减呈递减趋势。(C)
相同浓度的DON对小鼠和猪卵母细胞影响的统计分析。灰色线代表鼠卵母细胞极体排出率,黑线代表猪卵母细胞极体排出率。*,显著,P<0.05;**,显著,P<0.01;***,显著,P<0.001。
3. HT-2对小鼠和猪卵母细胞成熟的影响
观察HT-2对小鼠和猪的卵母细胞的影响,用10、20、30和40nM的HT-2培养小鼠卵母细胞12h,对照组的平均极体排出率为73.08±1.67%(n=153)(Fig. 3A)。然而10 nMHT-2处理(43.33±4.93%,n=176,p<0.05),20 nMHT-2处理(33.05±2.18%,n=163,p<0.001),30nMHT-2处理(7.08±0.89%,n=150,p<0.001),40nMHT-2处理(1.05±0.10%,n=169,p<0.001)的极体排出率与对照组相比是显著降低的。
将猪卵母细胞在10、50、100、150、200和400nM的HT-2中培养44h,与小鼠卵母细胞相似,我们发现HT-2对猪卵母细胞的成熟有影响。猪卵母细胞对照组的极体排出率为78.19±2.03%(n=171),接近小鼠对照组的极体排出率。除10nMHT-2处理组(68.67±2.99%,n=163,p>0.05)外,50nMHT-2处理(47.4±3.36%,n=156,p<0.01)、100nMHT-2处理(25.50±5.14%,n=164,p<0.01)、150nM HT-2处理(21.22±4.07%,n=188,p<0.01)、200nMHT-2处理(18.02±6.69%,n=175,p<0.01),400nMHT-2处理(8.22±0.78%,n=162,p<0.001)的猪卵母细胞极体排出率均显著降低(Fig. 3B)。
小鼠和猪对照组的卵母细胞极体排出率相似,但在10nM的DON浓度下,小鼠和猪的排极体率有明显差异(p<0.01)(Fig. 3C)。实验结果表明,在相同浓度的HT-2处理下,小鼠卵母细胞极体排出率低于猪卵母细胞,说明小鼠卵母细胞对HT-2毒素的敏感性高于猪卵母细胞。
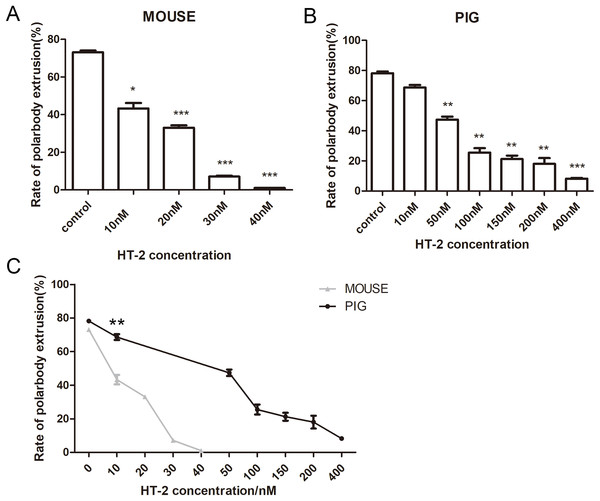
Figure 3 HT-2对卵母细胞成熟的影响。(A)浓度为0,10,20,30,40nM的HT-2处理小鼠卵母细胞,随着HT-2浓度的递增卵母细胞排极体率递减。(B)浓度0,10,50,100,150,200,400nM的HT-2处理猪的卵母细胞,随着HT-2浓度的递增卵母细胞排极体率递减(C)相同浓度的HT-2对小鼠和猪卵母细胞影响的统计分析。灰色线代表鼠卵母细胞极体排出率,黑线代表猪卵母细胞极体排出率。*,显著,P<0.05;**,显著,P<0.01;***,显著,P<0.001。
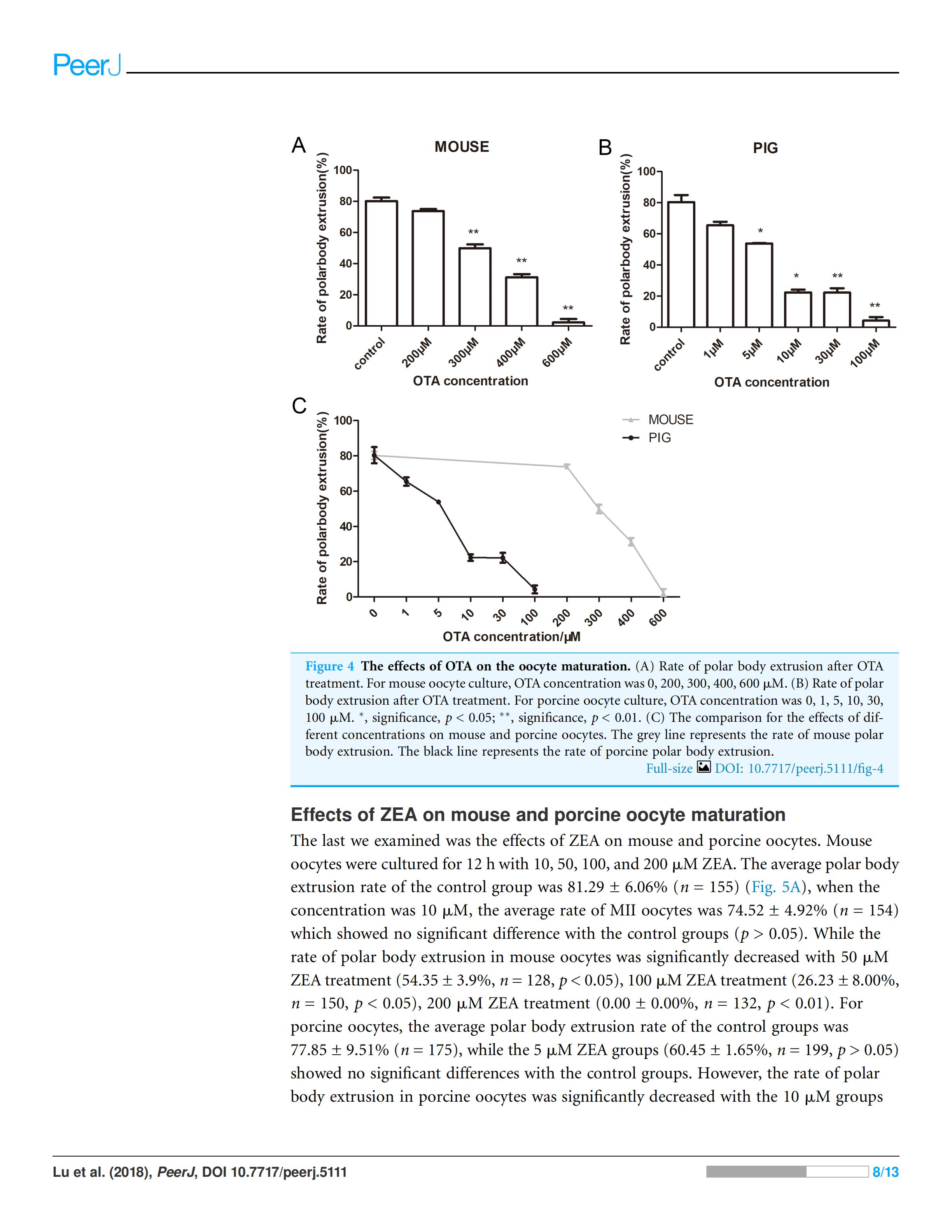
4. OTA对小鼠和猪卵母细胞成熟的影响
我们接着观察了OTA对小鼠和猪的卵母细胞的影响,用200、300、400和600μM的OTA处理培养小鼠卵母细胞12h,其对照组的平均极体排出率为80.23±3.87%(n=169) (Fig. 4A)。200μM的OTA浓度与对照组比较无显著性差异(73.77±2.24%,n=143,P>0.05),然而300μM的OTA处理(49.86±4.29%,n=190,p<0.01)、400μM的OTA处理(31.23±3.64%,n=145,p<0.01)、600μM的OTA处理(2.22±2.22%,n=178,p<0.01),卵母细胞极体排出率明显减少。
猪卵母细胞在1、5、10、30、100μM的OTA中培养44h,与小鼠卵母细胞相似,对照组与1μM的OTA处理组比较差异无显著性(80.34±7.95%n=164,65.46±4.09%,n=178,p>0.05)。而5μM的 OTA处理组(53.83±0.34%,n=154,p<0.05),10μM的OTA处理组(22.26±3.14%,n=183,p<0.05),30μM的OTA处理组(22.19±4.87%,140,p<0.01),100μM的OTA处理组(4.24±3.93%,n=144,p<0.01)卵母细胞排极体率显著降低(Fig. 4B)。
在相同浓度的OTA处理下,猪卵母细胞极体排出率低于小鼠卵母细胞(Fig. 4C),表明猪卵母细胞对OTA的敏感性高于小鼠卵母细胞。
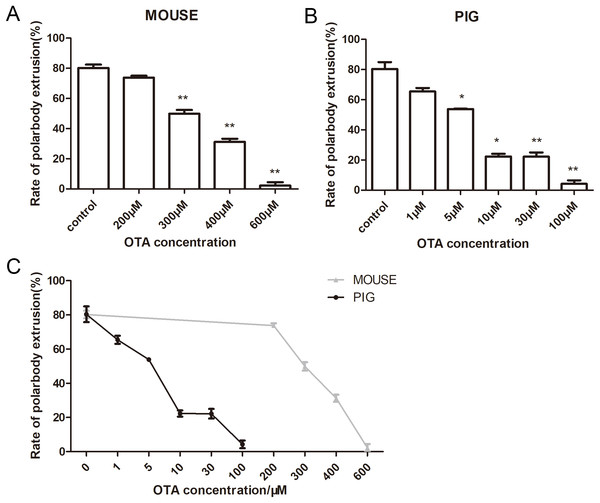
Figure 4 OTA对卵母细胞成熟的影响(A)OTA处理后小鼠的卵母细胞极体排出率。OTA浓度为0,200,300,400,600μM。(B)OTA处理后猪卵母细胞极体排出率。OTA浓度为0,1,5,10,30,100μM。(C)相同浓度的OTA对小鼠和猪卵母细胞影响的统计分析。灰色线代表鼠卵母细胞极体排出率,黑线代表猪卵母细胞极体排出率。*,显著,P<0.05;**,显著,P<0.01;***,显著,P<0.001。
5. ZEA对小鼠和猪卵母细胞成熟的影响
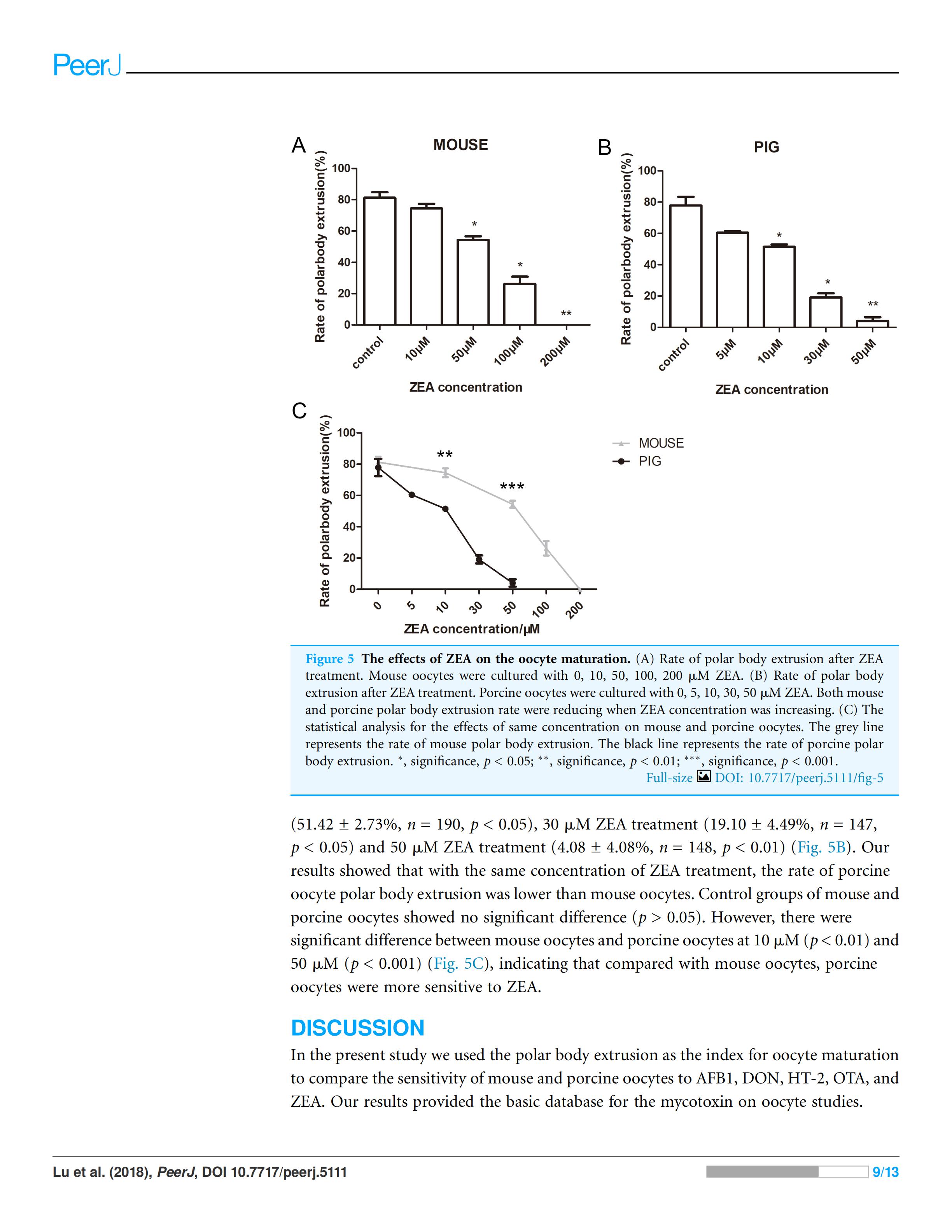
最后观察ZEA对小鼠和猪卵母细胞的影响,用10、50、100和200μM的ZEA处理,培养小鼠卵母细胞12h。对照组平均极体排出率为81.29±6.06%(n=155)(Fig. 5A),当ZEA浓度为10μM时,MII卵母细胞所占比率为74.52±4.92%(n=154),与对照组比较无显著性差异(P>0.05)。而50μMZEA处理组(54.35±3.9%,n=128,p<0.05),100μMZEA处理组(26.23±8.00%,n=150,p<0.05),200μMZEA处理组(0.00±0.00%,n=132,P<0.01),小鼠卵母细胞极体排出率显著降低。
对于猪卵母细胞来看,对照组的平均极体排出率为77.85±9.51%(n=175),5μM的ZEA处理组(60.45±1.65%,n=199,p>0.05)与对照组相比无显著性差异,但10μM的ZEA处理组(51.42±2.73%, n=190,p<0.05),30μM的ZEA 处理组(19.10±4.49%, n=147,p<0.05) 和50μM的ZEA 处理组(4.08±4.08%,n= 148,p<0.01)猪卵母细胞极体排出率明显降低(Fig. 5B)。
实验结果表明,在相同浓度的ZEA处理下,猪卵母细胞极体排出率低于小鼠卵母细胞,小鼠和猪卵母细胞对照组差异不显著(p>0.001),但在10μM和50μM时,小鼠卵母细胞与猪卵母细胞之间有显著性差异(p<0.001)(Fig. 5C),表明猪卵母细胞对ZEA的敏感性高于小鼠卵母细胞。
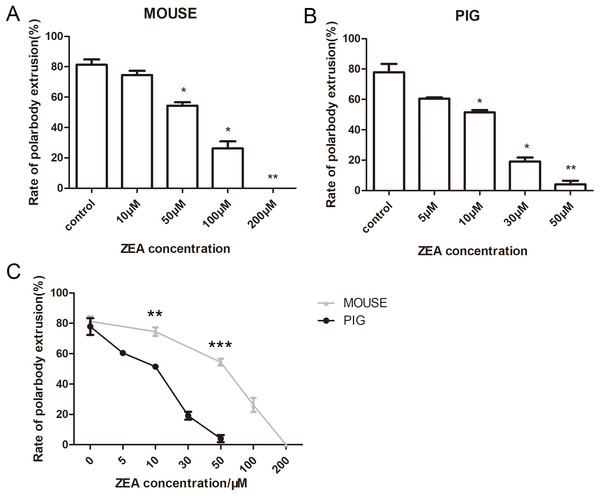
Figure 5 ZEA对卵母细胞成熟的影响(A)ZEA处理后小鼠卵母细胞排极体情况。ZEA浓度为10,50,100,200μM。(B)ZEA处理后猪卵母细胞排极体情况。ZEA浓度为5,10,30,50μM.(C)相同浓度的ZEA对小鼠和猪卵母细胞影响的统计分析。灰色线代表鼠卵母细胞极体排出率,黑线代表猪卵母细胞极体排出率。*,显著,P<0.05;**,显著,P<0.01;***,显著,P<0.001。
四 讨论
本研究以极体排出率作为卵母细胞成熟的标准,比较了小鼠和猪的卵母细胞对AFB1、DON、HT-2、OTA和ZEA的敏感性,为毒素的后续研究提供了基础数据库。
霉菌毒素对人和动物的健康有多方面的影响,如免疫系统、微生物等。近年来,大量报道了霉菌毒素对生殖系统的毒性,尤其是对卵母细胞和精子的毒性。我们以前的工作发现,在猪的卵母细胞中,50μM的AFB1影响COCs的生长,尤其是极体排出明显减少,并且10μM的AFB1可增加小鼠精子DNA片段化的比例。结果表明,即使在生殖系统中,不同细胞类型或动物模型对霉菌毒素的敏感性也不同,10μM的AFB1对猪卵母细胞成熟的影响大于50μM的AFB1在小鼠卵母细胞中的作用。
以前的研究表明,2μMDON对小鼠卵母细胞减数分裂中纺锤体的形成有影响。而最近的一项研究表明,10μM的DON会影响猪卵巢的形态。我们最近的研究显示,3μM的DON处理改变了猪卵母细胞的自噬/凋亡和表观遗传修饰。本研究结果还表明,1μM的DON对猪卵母细胞成熟有影响,而在小鼠卵母细胞中为2μM的DON处理表现出与其相似的敏感性。HT-2与AFB 1和DON有不同的敏感性,HT-2毒素对小鼠卵母细胞的细胞骨架动力学、凋亡/自噬、氧化应激和表观遗传修饰有影响。我们的结果表明,10nM的HT-2影响小鼠卵母细胞成熟,而相似的的结果发生在50nM的 HT-2处理猪卵母细胞,另外还需要进一步研究HT-2毒素在不同生殖细胞类型如卵丘细胞和精子中的毒性作用。
我们的结果表明,50μM的OTA影响猪卵母细胞的成熟,而在小鼠卵母细胞中300μM的OTA影响卵母细胞成熟。影响体内外模型小鼠卵母细胞的OTA浓度差异很大,有待进一步研究。对于ZEA来说,在30μM的浓度下,ZEA通过氧化应激、自噬和早期凋亡对猪卵母细胞的成熟和胚胎发育产生影响;而对小鼠卵母细胞来说,它通过改变表观遗传修饰水平来影响卵母细胞质量。实验结果表明,10μM的ZEA对猪卵母细胞成熟的的影响大于50μM的ZEA对小鼠卵母细胞成熟的影响,与AFB 1和DON有相似的浓度模式。
五 结论
综上所述,我们的实验结果表明,这5种霉菌毒素均影响小鼠和猪卵母细胞的质量,但小鼠和猪卵母细胞对毒素的敏感性不同。除了HT-2毒素外,猪卵母细胞对AFB1,DON,OTA,ZEA的敏感性高于小鼠卵母细胞。本研究结果为哺乳动物卵母细胞的进一步研究提供了基础数据库。









地址:南京市溧水区白马镇食品园大道2号
Copyright © 江苏奥迈生物科技有限公司 版权所有 苏ICP备17051433号

邮编:211225 电话:025-56211118 传真:025-57251588